 发布时间:2023-03-02
发布时间:2023-03-02
 浏览次数:864
浏览次数:864
 发布者:Admin
发布者:Admin
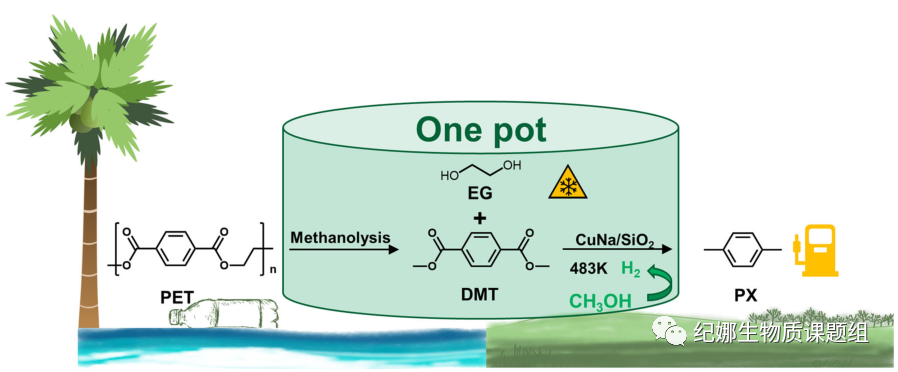
为了解决白色塑料污染严重的问题,本文报道了一种在改性的铜/二氧化硅催化剂上,以甲醇为溶剂和供氢体,将聚对苯二甲酸乙二醇酯(PET)定量转化为对二甲苯(PX)和乙二醇(EG)的低成本工艺。动力学和原位傅里叶变换红外光谱(FTIR)研究表明,PET降解成PX包括串联的PET甲烷解和DMT选择性加氢脱氧(HDO)步骤,以及210 ℃下甲醇分解原位生成的H2。总体上,高活性归因于致密的颗粒状硅酸铜前驱体产生的高Cu+/Cu0比,这是在水热合成过程中引入适当的氯化钠而形成的。这种无氢一锅法能够直接从废弃的聚酯塑料中生产汽油燃料和防冻剂成分,为岛屿的塑料问题提供了一个可行的解决方案。
背景介绍
对苯二甲酸乙二醇酯(PET)是储量最大的聚酯塑料,全球年产量近7000万吨。然而,PET在使用后不易降解。每年有1000万吨的PET废物排放到海洋中,来自纺织和包装行业的PET残留物数量尤其高。因此,海洋生物的健康正受到严重威胁。PET的解聚和再利用是解决这一问题的最常用的方法。化学解聚方法主要包括水解、糖酵解、氨解和裂解,可以保留塑料的化学成分,并转化为稳定的单体分子。然而,这些方法仍然面临着反应条件苛刻、产品收率低和提纯困难等局限性。
最近在解决海洋塑料污染方面的趋势导致了对聚酯化学加工的研究激增。Yan和Wang等人使用Ru/Nb2O5将PET转化为87.1%的混合芳烃,在200
℃和0.3 MPa H2的水中对二甲苯(PX)的选择性为63%。Wang等人利用PET结构中的乙二醇碎片通过水相重整提供氢源,在220 ℃的水中,与Ru/Nb2O5相比,生成了91.3%的单体,对PX的选择性为19%。然而,Ru的使用增加了催化剂的成本,这些催化体系导致芳烃混合物产物对PX的选择性较低。同样,Yan等人展示了在340 ℃和3 MPa
H2的条件下,在Co/TiO2催化剂上,在辛烷中将PET转化为70%的芳烃。Li和Zhang等人通过三步反应将PET转化为C7-C8环烷烃和芳烃。近年来,光催化和电催化重整回收聚酯废弃物成为一种新的策略。Erwin等人报道了在常温下将PET高效地光转化为H2和有机产品,如甲酸盐、醋酸盐和丙酮酸。Duan等人报道了CoNi0.25P上PET的电催化上循环生成二甲酸钾、对苯二甲酸和氢气。
本文亮点
这项研究开发了一种不含氢的一锅法,使用低成本的铜基催化剂直接将PET和PBT废物转化为汽油燃料和防冻剂成分(图1)。在此过程中,甲醇既是PET甲醇裂解生成DMT和EG的溶剂,又是DMT选择性加氢脱氧生成PX的氢源。在水热合成过程中加入氯化钠,对催化剂的结构和形成过程进行了表征。同时通过动力学和原位傅里叶变换红外光谱(FTIR)研究了整个PET转化的反应机理。
Fig. 1 Strategy. Strategy for the depolymerization and
conversion of PET wastes.
醇中PET无氢转化的催化试验…
以醇为供氢体的PET解聚集成体系包括几个反应步骤:醇脱氢制氢、PET醇解和单体加氢脱氧。实验证明,在没有催化剂的情况下,在210 ℃的甲醇中可以直接进行PET的醇解,在30分钟内获得100%的DMT单体产率。因此,我们主要致力于甲醇脱氢和DMT加氢脱氧催化剂的开发,以实现PET在甲醇中的整体转化。表1列出了不同的催化剂在210 ℃的甲醇中转化为下游产物的性能。除了Cu/SiO2(HT)的产率为73%外,几乎所有的催化剂都是无效的,而副产物4-甲基苯甲酸甲酯和4-甲基苯甲醇的产率分别为23%和4%。有趣的是,Co/SiO2、Ni/SiO2、Fe/SiO2在整个反应中没有表现出活性。一旦PET解聚成DMT单体,由于Co、Ni和Fe活性中心几乎不能催化甲醇脱氢,导致DMT加氢脱氧缺乏氢气,导致加氢脱氧反应停止。
随后,以铜为金属活性中心,考察了载体对反应的影响。与Cu/SiO2不同,Cu/TiO2(PX产率为17%)、Cu/CeO2和Cu/ZrO2(PX产率为0%)表现出较差的性能。我们推测,SiO2具有比TiO2、CeO2和ZrO2更无定形的结构,并且很容易被氨气腐蚀而形成强烈的硅酸铜结构。这种硅酸铜前驱体结构有利于甲醇脱氢反应部分还原为Cu+和Cu0。
通过比较不同铜基催化剂对聚对苯二甲酸乙二酯转化率的影响,考察了Cu/SiO2的合成方法。采用水热法(HT)、浸渍法(IM)、尿素沉积-沉淀法(DPU)、氨沉积-沉淀法(DPA)等方法制备了几种铜基催化剂。只有HT型和DPA法制备的Cu/SiO2催化剂具有甲醇脱氢反应活性,制氢压力分别为2.9和0.8 MPa。如上所述,该氢可用于后续的DMT加氢脱氧。然而,PET在Cu/SiO2(DPA)上的加氢脱氧反应在中间产物4-甲基苯甲酸甲酯处停止,很可能是因为在甲醇脱氢过程中没有释放足够的氢来将PET完全转化为PX。
与HT和DPA方法不同,IM和DPU方法制备的催化剂中的铜物种在完全还原后生成Cu0物种。此外,铜的XPS表明,Cu2+在HT和DPA样品上被不完全还原。DPU、DPA和IM样品中的Cu+/Cu0比值显著低于HT样品。在以前的工作中,证明了Cu2O和Cu的混合物是甲醇脱氢的活性中心。这可以解释为什么Cu/SiO2(IM)和Cu/SiO2(DPU)催化剂活性较低,无法为DMT加氢脱氧反应提供所需的氢气。在下一步中,我们尝试通过水热处理以氯化物的形式引入碱金属(如Na、Li、K、Rb和Cs)来考察催化剂的活性。在CuNa/SiO2(HT)上获得了100%的PX产率。因此,NaCl的加入显著促进了Cu/SiO2(HT)催化剂上PET向PX的转化。
在170-210℃时,PET醇解的温度效应和用Cu/SiO2(HT)对PET进一步加氢脱氧的温度效显示,在200 ℃时,PET在甲醇中完全解聚为DMT和EG,但PX的产率下降到93.6%。附注中还指出,根据产品计算的甲醇消耗量与甲醇的实际消耗量和原位生成的氢气很好地匹配。
在随后的实验中,还测试了乙醇和异丙醇作为PET转化的溶剂和供氢体。实验数据表明,在无催化剂的情况下,在210 ℃的反应温度下,两种溶剂均能很好地醇解PET,0.5h后单体的产率分别达到80.3%和73.5%。然而,在CuNa/SiO2(HT)上进一步的PET催化转化试验中,从PET得到的单体没有加氢,在乙醇或异丙醇溶剂中也没有生成对二甲苯,这可能是由于该催化体系中没有足够的氢气释放所致。为了扩大塑料的利用率,我们还在相同系统下测试了另一种塑料聚对苯二甲酸丁二醇酯(PBT),所得结果与PET转化率非常相似。在210 ℃下,以甲醇为溶剂的PBT反应可获得100%的对二甲苯和1,4-丁二醇产率,释放出2.8 MPa的气体(60% H2)。
CuNa/SiO2催化剂的结构表征…
为了在CuNa/SiO2催化剂上实现高活性的PET转化,进行了一系列表征。用高温气相沉积法制备的Cu2Si2O5(OH)2(2θ=19.9,21.8,30.8,35.0,57.5和62.4°) (图2a)的X射线衍射峰特征,氯化钠的加入降低了硅酸铜的结晶度,减小了铜纳米粒子的尺寸,使其尺寸分布更加均匀。硅酸铜的特征峰在空气焙烧和氢气还原后消失,取而代之的是铜的特征峰(2θ=43.3°)和Cu2O(2θ=36.4、42.3、61.3和77.3°)。氮气吸附-脱附实验表明,干燥后的Cu/SiO2前驱体的比表面积为277.9 m2g−1,介孔体积为0.08cm3g−1(图2b)。加入Na+后,比表面积减小了5/6(46.9m2g−1),介孔体积也显著减小(0.06cm3g−1)。总体而言,整个结构变得更加密集。
干燥的Cu/SiO2前驱体样品的氢程序升温还原(H2-TPR)曲线在256 ℃和280 ℃显示还原峰,分别归因于硅酸铜还原为Cu2O·SiO2和Cu0。加入氯化钠后,在274 ℃和299 ℃的高温下出现了还原峰,表明铜颗粒与载体之间有较强的相互作用。H2-TPR表明,这种致密结构相对较难还原。在2125和2111 cm−1处的FTIR光谱上,与Cu/SiO2相比,还原后的CuNa/SiO2的Cu+位点上CO吸附量减少,这可能是由于CuNa/SiO2样品的表面积大大减少。
测量了不同状态的Cu/SiO2和CuNa/SiO2的红外光谱,发现两个干燥样品在669 cm−1处都有一个特征的O-H伸缩振动峰,该振动峰归因于硅酸铜物种。这些结果与X射线衍射仪的结果相吻合。在795 cm−1处的峰是由无定形二氧化硅载体上的Si-O键的弯曲振动引起的。硅酸铜的相对含量由两个峰(即I669/I795)的强度决定。空气焙烧后,硅酸铜的特征峰强度略有下降,这可能是由于硅酸铜在焙烧过程中失去了部分结晶水,结晶度较低所致。此外,还原样品中669 cm−1处的特征峰几乎消失,表明大部分硅酸铜可能已被氢还原为铜物种。
前驱体的热重分析(TGA)表明,硅酸铜前驱体的物理吸附水在低于130 ℃的温度下被去除。随着温度上升到600 ℃,结晶水逐渐被去除,硅酸铜分解为CuO和SiO2。加入氯化钠后,硅酸铜前驱体的含水率降低了6.09%,说明硅酸铜结构更加致密。
根据Cu XPS和Auger Cu LMM谱计算了还原样品的表面组成。由XPS分析得到的Cu/SiO2和CuNa/SiO2的表面总含量分别为4.68%和5.92%。这些值比用电感耦合等离子体发射光谱仪测得的值小,因为XPS检测表面的铜物种,而电感耦合等离子体发射光谱仪测量总的铜含量。XPS的940-950 eV处的Cu2+卫星峰显示硅酸铜前体的不完全还原(图2d和f)。Cu2+/T(Cu)在CuNa/SiO2(0.44%)中的比值(0.44%)远大于Cu/SiO2(0.37%),这是由于其较难还原硅酸铜。由于Cu 2p3/2(932.1 eV)和Cu 2p1/2(952.2
eV)中的Cu0和Cu+物种太接近而无法区分,我们用Cu LMM X射线诱导俄歇电子能谱直观地测定了Cu+/Cu0比值(图2c和e)。CuNa/SiO2较高的Cu+/Cu0比(1.87)证实了Na+的加入使织构致密的硅酸铜不易还原为Cu0。Cu+/Cu0值越高,甲醇脱氢和DMT加氢脱氧活性越高。
透射电子显微镜图像直观地显示了在水热合成过程中引入和不引入氯化钠形成的两种不同形貌的硅酸铜。因此,当干燥的Cu/SiO2前驱体显示出层状的硅酸铜结构(图2g)时,CuNa/SiO2的干燥前驱体显示出一种特殊的颗粒积累状态(图2i)。在H2下还原后,高分辨电子显微镜(HRTEM)显示CuNa/SiO2中的铜颗粒尺寸分布集中在3.9 ± 0.9 nm(图2j),而Cu/SiO2中的铜颗粒尺寸较小(5.1 ± 1.5 nm)(图2h)。透射电子显微镜图谱证实,铜和钠均匀分布在SiO2上。扫描电子显微镜显示,经过空气焙烧和氢气还原后,CuNa/SiO2比Cu/SiO2有更多的小颗粒颗粒。
与传统的Cu/SiO2相比,添加Na+后形成的结晶度较差的粒状硅酸铜具有非常致密的结构,比表面积为46.9m2
g-1,中孔体积为0.06cm3 g-1。
Na+/Cu2+摩尔比对形成的CuNa/SiO2催化剂及其活性的影响…
为了进一步探究NaCl的加入对催化剂形成的影响,进行了一系列表征试验。2.5:1、5:1、10:1、15:1的Na+/Cu2+ 摩尔比值分别记为2.5 NaCl、5NaCl、10
NaCl、and 15 NaCl。前驱体样品均表现出Cu2Si2O5(OH)2晶体相的特征衍射峰,说明NaCl的加入不影响催化剂的相组成。在5NaCl样品中,硅酸盐铜的结晶度较其他样品差。N2吸附-解吸图表明,加入5NaCl时,CuNa/SiO2的比表面积最小(46.9 m2 g−1),表明所测样品中形成的结构最致密。CuNa/SiO2前驱体的TGA测试结果表明,添加5个NaCl时,其物理吸附水(2.41%)和结晶水(6.75%)在所有样品中最低。这也证实了在这个比例下,铜硅酸盐结构的密度最大。在Cu
2p和Cu LMM XAES还原后的CuNa/SiO2的XPS (Cu 2p)和cum MXAES剖面中,Cu+/Cu0比值仍然呈现火山型分布,当加入5个NaCl时,CuNa/SiO2的Cu+/Cu0比值最高(1.86)。
在接下来的步骤中,考察了水热处理过程中产生的不同的Na+/Cu2+摩尔比对CuNa/SiO2性能的影响。在210 ℃的PET活性测试中,PX在5个氯化钠样品中的产率最高,为100%,而在2.5个氯化钠、10个氯化钠和15个氯化钠的样品中,PX的产率分别为78.3%、92.3%和60.7%。
最后,尝试使用最优的Cu-5Na/SiO2进行循环反应测试。用过的催化剂在第二浴中仍能保持96.4%的对二甲苯转化率,但在第三浴时,对二甲苯的收率下降到52.7%。催化剂失活可能是由于回收测试后铜颗粒增大,如X射线衍射图和透射电子显微镜图像所证实,以及通过甲醇脱氢产生的过量氢还原了铜物种。X-射线光电子能谱分析证明,经过4次循环后,Cu+/Cu0的比值从1.87急剧下降到0.57,这阻碍了Cu0和Cu+在催化过程中的协同作用。
CuNa/SiO2催化剂的结构形成机理…
在传统的水热合成工艺中(图3a),溶液中的Cu2+与二氧化硅表面的硅醇结合形成硅酸铜,显著促进了层状硅酸铜的形核和生长。这种类型的层状硅酸铜导致了层状硅酸铜表面上的低Cu+/Cu0比(图2c)。
在水热合成过程中加入5NaCl后(图3b),一定量的Na+占据了二氧化硅表面的硅醇,从而抑制了层状硅酸铜的成核和生长(图2g,i)。溶液中的Cu2+只能与残留在SiO2表面的硅醇结合形成分散孤立的硅酸铜颗粒,且致密结构比表面积小,结晶度差。形成的颗粒状硅酸铜与SiO2有很大的界面面积,因为真空中红外光谱没有检测到CuNa/SiO2上剩余的Si-OH。与传统的层状硅酸铜相比,颗粒状硅酸铜更难还原,导致制备的催化剂中有较高的Cu+/Cu0活性中心比率。
然而,当水热合成过程中添加的15NaCl的量太高时(图3c),Na+占据了SiO2上所有的硅醇位,导致Cu2+与SiO32−在溶液中沉淀形成硅酸铜,然后沉积在SiO2表面。与水热处理中引入的5NaCl催化剂相比,这种类型的硅酸铜表现出更好的结晶度和与SiO2的小界面面积,并且相对容易被还原为Cu/Cu2O·SiO2,形成低的Cu+/Cu0比。
为了确定氯化钠的加入是否只影响硅酸铜的形成过程,还是对反应本身有促进作用,我们制备了一种铜/二氧化硅-羟色胺-钠-IM样品。我们首先用水热法合成了Cu/SiO2,然后在层状硅酸铜形成后用氯化钠浸渍了它。新的硅酸铜前驱体具有与CuNa/SiO2相同的Na+负载量(2.4%)。X射线衍射表明,尽管PX的产率适中(65.8%),但浸渍的Na+不影响硅酸铜的形成。因此,证实了水热处理中添加氯化钠影响了硅酸铜的形貌,从而影响了还原后的铜/铜比。硅酸铜形成后的Na浸渍不仅没有提高催化剂的活性,而且覆盖了活性中心,导致PX产率下降。
一般情况下,水热处理中添加5%的氯化钠,会形成结晶度较低、比表面积较小、织构较致密的粒状硅酸铜。当Na+/Cu2+的摩尔比达到5:1时,Cu2+/Cu0达到最大值(1.86),为甲醇脱氢和DMT加氢脱氧提供了更多的活性中心。
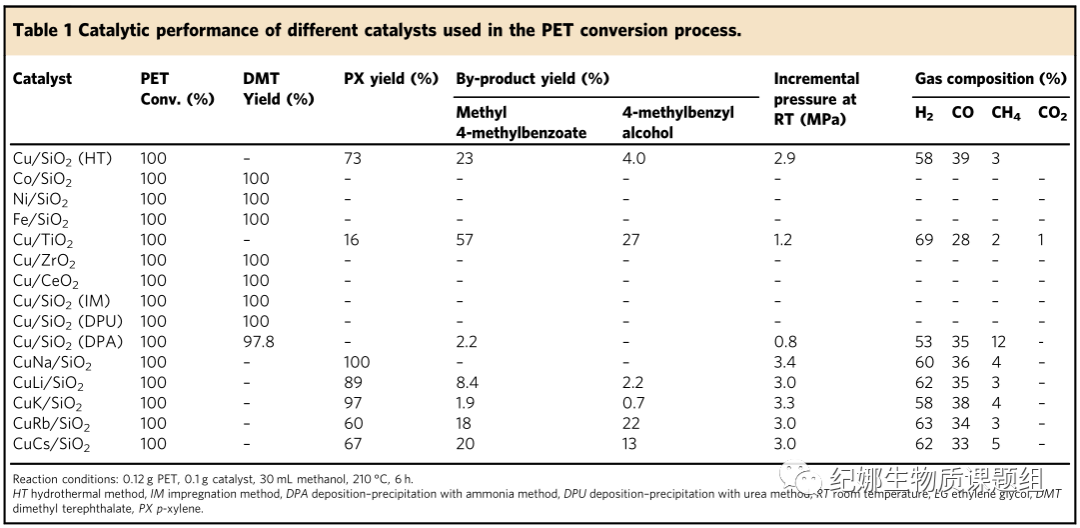
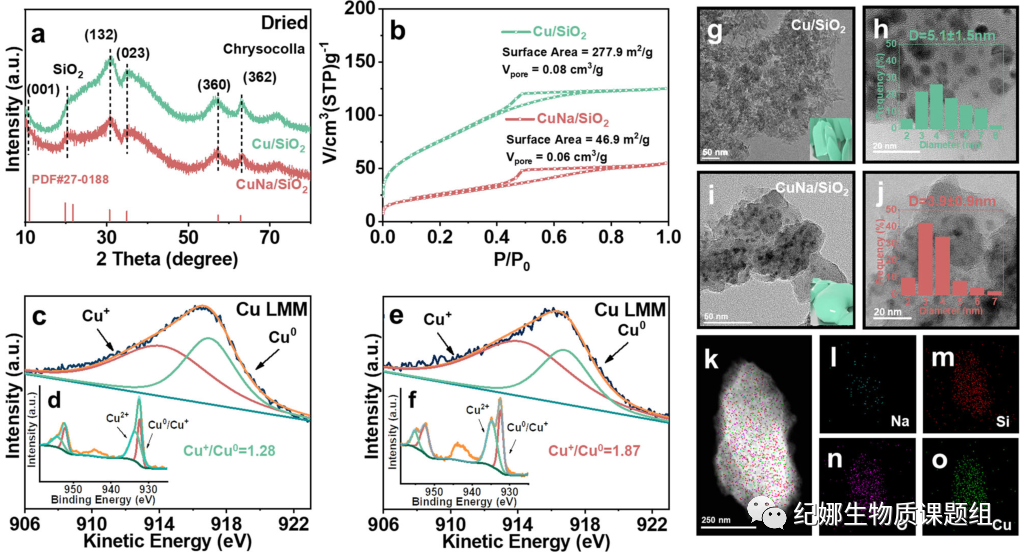
Fig. 2 Structural characterizations. a X-ray diffraction
(XRD) patterns of Cu/SiO2 (dried) and CuNa/SiO2 (dried). b N2 adsorption–desorption
of Cu/SiO2 (dried) and CuNa/SiO2 (dried). X-ray photoelectron
spectroscopy (XPS) Cu 2p spectra of d Cu/SiO2 (reduced) and f CuNa/SiO2 (reduced).
Cu LMM X-ray induced Auger electron spectroscopy (XAES) spectra of c Cu/SiO2 (reduced)
and e CuNa/SiO2 (reduced). g Transmission electron microscopy (TEM) images
of Cu/SiO2 (dried), h Cu/SiO2 (reduced) at a higher magnification, i
CuNa/SiO2 (dried), and j CuNa/SiO2 (reduced) at higher magnification.
k Transmission electron spectroscopy–energy dispersive X-ray spectroscopy
(TEM-EDS) mappings of the elements in CuNa/SiO2: (l) Na , (m) Si , (n) O , and
(o) Cu.
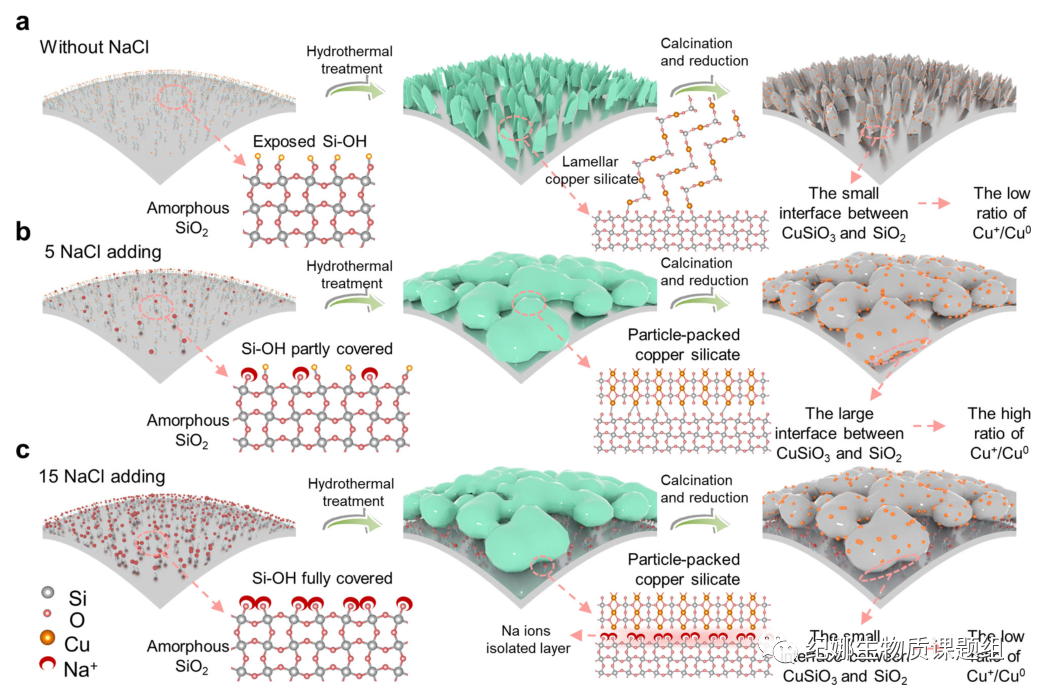
Fig. 3 Structural formation processes. a Without NaCl adding,
b with 5 NaCl adding, c with 15 NaCl adding copper silicate formation processes
with different amounts of introduced NaCl.
DMT在甲醇中加氢脱氧生成PX的反应路径…
用优化的Cu5Na/SiO2对DMT(A)与中间体在最佳反应温度(210 ℃)下的反应进行了动力学研究,并监测了产物随时间的分布。反应一开始,DMT的浓度就以0.36 g−1 h−1的初始速度下降(图4a),显示出高的制氢效率。氢气是在加热过程中产生的,足以维持后续反应所需的氢气量。反应开始时,生成中间体4-甲基苯甲酸甲酯(C),1.5 h时最高产率为24.3%,1~1.5 h内,中间体4-甲基苯甲醇(D)生成缓慢。反应3 h时,DMT几乎全部转化,6 h时目标产物PX的产率达到100%。
在本动力学研究中,只观察到两个中间体:C和D。重要的是,我们没有观察到1,4-苯二甲醇,这意味着DMT在CuNa/SiO2上发生了单面吸附。因此,4-(羟甲基)苯甲酸甲酯(B)可能暂时作为中间产物出现。根据这些结果,我们推测DMT到PX的反应包括四个步骤:(1)DMT的酯在CuNa/SiO2上的单面吸附,然后加氢生成醇,生成B;(2)B的醇经过氢解成甲基并解吸成C;(3)酯C吸附在CuNa/SiO2上,氢化成醇得到D;(4)醇D氢解成甲基并解吸得到目标产物PX。在相同条件下研究了三种中间体的动力学(图4b-d)。中间产物A、B、C和D分别在大约5、1.5、5和1小时后被完全消耗。实验结果证实了我们提出的反应途径。利用MatLab进行的模拟结果得到了每一步的速率常数(K1=0.0121
min−1,K2=0.0424
min−1,K3=0.0104
min−1,K4=0.0468
min−1)。值得注意的是,在DMT加氢后,C的浓度最大。这是因为步骤(2)和(3)需要在CuNa/SiO2上进行中间C的脱附和再吸附,使得C的加氢成为整个过程的速率决定步骤(K3=0.0104 min−1)。醇的氢解速率约为酯氢解的4倍。
原位FTIR也证实了DMT和中间体(B、C和D)在CuNa/SiO2上的转化过程。在红外光谱的四个区域出现了不同的底物官能团:(1)芳基C=C,1494,1523
cm−1,(2)芳基C=O,1594-1664 cm−1,(3)芳基-CH3伸缩,2950-2863 cm−1,和(4)O-H,3305-3290 cm−1。值得注意的是,四种底物在1494和1523 cm−1处的芳基C=C带在反应过程中没有改变,表明在反应过程中芳香结构保持不变,芳香烃倾向于生成。中间体A、B和C的C=O伸缩振动峰在1594-1664 cm−1处随时间不断下降,直到完全消失(图4e-g)。这一现象表明,加氢反应是在原位条件下连续进行的。本身没有羟基的A和C在3305-3290 cm−1处产生O-H振动峰,然后逐渐消失(图4e和g),表明C=O氢化为羟基,然后发生氢解,与动力学结果一致。此外,由于氢解作用,对应于B和C的羟基的谱带逐渐减少,直至消失。最后,PX的-CH3振动峰随时间不断增大。原位红外光谱研究再次证实了DMT在CuNa/SiO2上的转化路径,其结果与动力学行为高度一致。
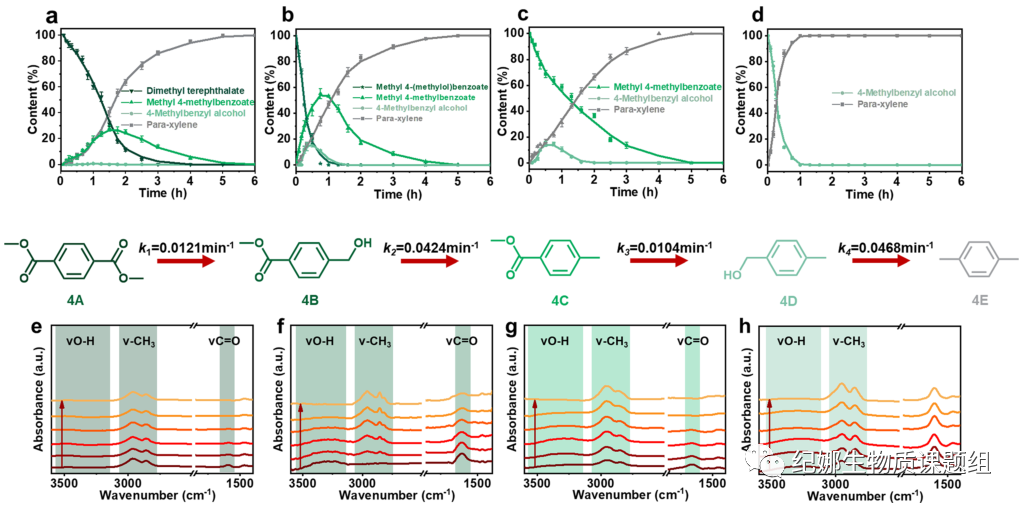
Fig. 4 Kinetic and in-situ Fourier-transform infrared
spectroscopy (FTIR) studies. Product distribution–reaction time curves for the
catalytic conversion of: a dimethyl terephthalate (A), b methyl
4-(methylol)benzoate (B), c methyl 4-methylbenzoate (C), and d 4-methylbenzyl
alcohol (D) on CuNa/SiO2.Reaction conditions: PET, 0.12 g; CuNa/SiO2 catalyst,
0.1 g; methanol, 30 mL; 210 °C; 6 h. Data are presented as mean ± s.d. of three
independent experiments. Time-resolved in-situ transmitted Fourier-transform
infrared spectroscopy difference spectra of e dimethyl terephthalate (A), f
methyl 4-(methylol)benzoate (B), g methyl 4-methylbenzoate (C), and h
4-methylbenzyl alcohol (D) conversion CuNa/SiO2 in methanol over at 120 °C
from 10 to 60 min.
聚酯回收的现场测试…
最后,使用我们的PET转换方法对一个岛屿进行了初步的现场测试(图5)。最近对普吉岛海岸线海滩沉积物的调查显示,聚酯(主要包括饮料瓶、塑料薄膜和微波包装)约占塑料沉积物总量的33.1%。旅游岛上几种常见的PET塑料被选为改装,如可口可乐瓶子、麦当劳饮料帽、一次性午餐盒、包装袋,甚至一些聚酯衣服。用剪刀对原料进行简单处理后,在相同的催化条件下,从不同来源的PET塑料中获得100%的对二甲苯产率。每吨塑料沉淀物中含有331公斤的聚酯,在最佳条件下,通过该路线可获得181公斤的对二甲苯和105公斤的乙二醇。这些产品和甲醇可以很容易地通过简单的蒸馏分离。所得PX和EG可用作汽车燃料和防冻剂补充剂。
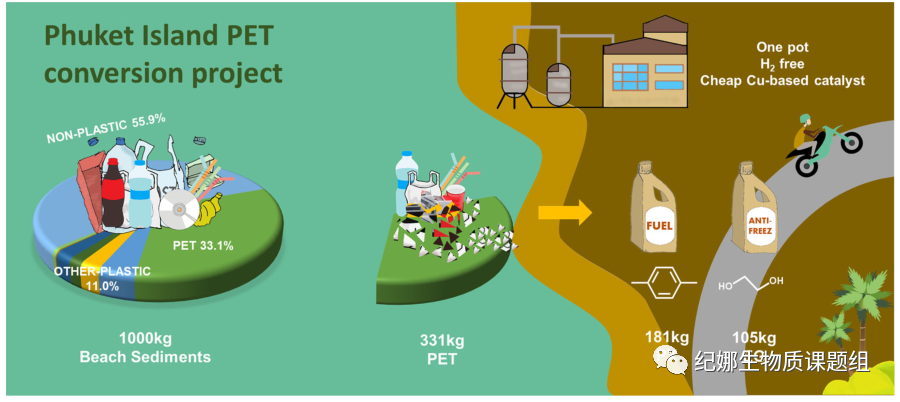
Fig. 5 Preliminary on-site test. Schematic diagram for
application of new PET conversion project on sediments from Phuket Island.
总结与展望
在这项工作中,展示了低成本的CuNa/SiO2为处理堆积在岛屿上的废旧PET和PBT提供了一个可行的选择,而不需要外部氢气,将其转化为高附加值的能源供应。该系统集成了甲醇脱氢和PET甲醇分解以及随后的DMT加氢脱氧生成PX的原位制氢。这种多功能是在通过还原致密的颗粒状硅酸铜前驱体而得到的高Cu+/Cu0比的Cu/SiO2催化剂上实现的。这种开发的聚酯塑料绿色化学回收工艺可以应用于资源稀缺、海洋塑料积累量高的海岛,直接为车辆提供能源供应,从而使海岛的经济受益。
链接:
